Рецептурний лікарський препарат
Айлар®
ПОКАЗАННЯ ДО ЗАСТОСУВАННЯ:
- Лікування цукрового діабету у дорослих, підлітків та дітей віком від 2 років.
Розчин для ін'єкцій
Підшкірне введення
Для дорослих та дітей з 2х років


Рецептурний лікарський препарат
ПОКАЗАННЯ ДО ЗАСТОСУВАННЯ:
Розчин для ін'єкцій
Підшкірне введення
Для дорослих та дітей з 2х років
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України 13.01.2022 № 56
Реєстраційне посвідчення № UA/15749/01/01
Продукт входить до державної програми «Національний кешбек»

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
АЙЛАР® (ILAR®)
діюча речовина: інсулін гларгін;
1 мл розчину містить 3,6378 мг інсуліну гларгіну (ДНК-рекомбінантного), що еквівалентно 100 одиницям інсуліну гларгіну;
1 картридж містить 3 мл розчину для ін’єкцій, що відповідає 300 одиницям інсуліну гларгіну;
1 флакон містить 10 мл розчину для ін’єкцій, що відповідає 1000 одиниць інсуліну гларгіну;
допоміжні речовини: метакрезол, гліцерин (85 %), цинку хлорид, кислота хлористоводнева розведена або розчин натрію гідроксиду, вода для ін’єкцій.
Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий безбарвний розчин.
Інсуліни та аналоги тривалої дії для ін’єкцій.
Код АТХ А10А Е04.
Фармакодинаміка.
Інсулін гларгін розроблений як аналог інсуліну людини, який має низьку розчинність у нейтральному середовищі. У лікарському засобі він є повністю розчинним завдяки кислому середовищу розчину для ін’єкцій (рН 4). Після введення у підшкірні тканини кислий розчин нейтралізується, що спричиняє виникнення мікропреципітатів, з яких постійно вивільняється невелика кількість інсуліну гларгіну. Це забезпечує плавний (без піків) та передбачуваний профіль кривої залежності «концентрації – час», а також більш тривалу дію препарату.
Інсулін гларгін метаболізується до 2 активних метаболітів – M1 та M2 (див. розділ «Фармакокінетика»).
Зв’язування з інсуліновим рецептором: результати досліджень in vitro свідчать про те, що афінність інсуліну гларгіну та його метаболітів M1 і M2 до інсулінового рецептора людини подібна до афінності людського інсуліну.
Зв’язування з рецептором ІФР-1 (інсуліноподібного фактора росту 1): афінність інсуліну гларгіну до рецептора ІФР-1 приблизно у 5–8 разів вища за афінність людського інсуліну (але приблизно у 70–80 разів нижча, ніж афінність ІФР-1 до цього рецептора), у той час як метаболіти M1 і M2 зв’язуються з рецептором ІФР-1 з афінністю, дещо нижчою за афінність людського інсуліну.
Загальна терапевтична концентрація інсуліну (інсуліну гларгіну та його метаболітів), що визначалася у пацієнтів з цукровим діабетом I типу, була значно нижчою за ту, яка була б необхідною для напівмаксимального зв’язування з рецептором ІФР-1 та для наступної активації мітогенно-проліферативного механізму, який запускається рецептором ІФР-1. Ендогенний ІФР‑1 у фізіологічних концентраціях може активувати мітогенно-проліферативний механізм; проте терапевтичні концентрації інсуліну, які використовуються при інсулінотерапії, в тому числі при терапії інсуліном гларгіном, значно нижчі за фармакологічні концентрації, необхідні для активації ІФР-1-опосередкованого механізму.
Найважливішою дією інсуліну, у тому числі інсуліну гларгіну, є регуляція метаболізму глюкози. Інсулін та його аналоги знижують рівень глюкози в крові за рахунок стимуляції її споживання периферичними тканинами, зокрема скелетними м’язами та жировою тканиною, а також пригнічення утворення глюкози у печінці. Інсулін пригнічує ліполіз в адипоцитах та протеоліз, одночасно посилюючи синтез білка.
Доведено еквівалентність однакових доз інсуліну гларгіну та інсуліну людини після внутрішньовенного введення цих препаратів. Як і при застосуванні будь-яких інсулінів, на характер дії інсуліну гларгіну у часі можуть впливати фізична активність та інші чинники.
Дослідження із застосуванням методу фіксації еуглікемічного стану, які проводилися за участю здорових добровольців і хворих на цукровий діабет І типу, продемонстрували, що, на відміну від НПХ (нейтрального протаміну Хагедорна) – інсуліну людини, початок дії інсуліну гларгіну після підшкірного введення настає пізніше, препарат діє плавно, не викликаючи появи піків концентрації глюкози у крові, а тривалість його дії пролонгована.
Результати одного з досліджень серед пацієнтів наведені на графіку нижче.
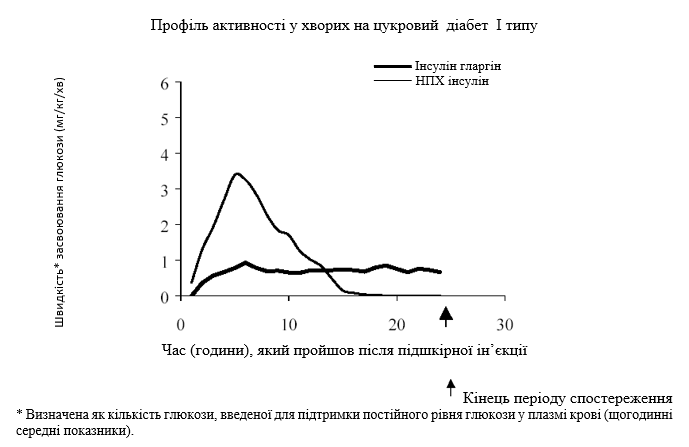
Більша тривалість дії підшкірно введеного інсуліну гларгіну безпосередньо пов’язана із повільнішою абсорбцією, що дозволяє застосовувати лікарський засіб один раз на добу. Характер дії у часі інсуліну та його аналогів, таких як інсулін гларгін, може мати значну індивідуальну варіабельність.
Після внутрішньовенного введення інсуліну гларгіну та інсуліну людини симптоми гіпоглікемії або контррегуляції гормональної відповіді були аналогічними у здорових добровольців та хворих на цукровий діабет I типу.
Вплив інсуліну гларгіну (який вводили 1 раз на добу) на перебіг діабетичної ретинопатії оцінювався під час відкритого п’ятирічного випробування, препаратом порівняння у якому був НПХ-інсулін (вводили 2 рази на добу). У випробуванні брали участь 1024 пацієнти з цукровим діабетом ІІ типу, у яких спостерігалося прогресування ретинопатії на 3 і більше пункти за шкалою, що застосовувалася у дослідженні «Раннє лікування діабетичної ретинопатії» [Early Treatment Diabetic Retinopathy Study (ETDRS)]. Прогресування оцінювалося за допомогою фотографування очного дна. Статистично значущої різниці між прогресуванням діабетичної ретинопатії при введенні інсуліну гларгіну та НПХ-інсуліну не було виявлено.
Дослідження ORIGIN (Outcome Reduction with Initial Glargine INtervention, «Зниження ризику несприятливих клінічних наслідків при первинному призначенні гларгіну») було багатоцентровим, рандомізованим дослідженням з факторіальним дизайном 2 × 2, що проводилося за участю 12 537 пацієнтів з високим серцево-судинним (СС) ризиком, у яких спостерігалася порушена глікемія натще (ПГН) або порушена толерантність до глюкози (ПТГ) (12 % учасників) чи цукровий діабет ІІ типу, з приводу якого вони отримували один чи кілька пероральних протидіабетичних препаратів (88 % учасників). Учасники дослідження були рандомізовані (1:1) для отримання або інсуліну гларгіну (n = 6264), доза якого титрувалася до досягнення рівня глюкози в плазмі крові натще ≤95 мг/дл (5,3 ммоль/л), або стандартної терапії (n = 6273).
Першим показником у складі комбінованої первинної кінцевої точки був час до першого настання смерті з СС причин, нелетального інфаркту міокарда (ІМ) або нелетального інсульту, а другим показником у складі комбінованої первинної кінцевої точки був час до першої появи будь-якого з цих явищ комбінованої первинної кінцевої точки або проведення процедури реваскуляризації (коронарних, сонних або периферичних судин), або госпіталізації з приводу серцевої недостатності.
До вторинних кінцевих точок належали смертність з усіх причин і комбінована кінцева точка мікроваскулярних явищ.
Інсулін гларгін не змінював відносний ризик СС захворювань і смерті з СС причин у порівнянні зі стандартною терапією. Не було відмічено різниці між інсуліном гларгіном і стандартною терапією за обома показниками у складі комбінованої первинної кінцевої точки; за жодною складовою кінцевої точки, що включає ці несприятливі клінічні наслідки; за смертністю з усіх причин; за комбінованою кінцевою точкою мікроваскулярних явищ.
Середня доза інсуліну гларгіну у кінці дослідження становила 0,42 одиниці/кг. На початку дослідження середній показник HbA1c в учасників становив 6,4 %, а на фоні досліджуваного лікування показники HbA1c варіювали від 5,9 до 6,4 % в групі застосування інсуліну гларгіну і від 6,2 % до 6,6 % в групі застосування стандартної терапії протягом усього періоду спостереження.
Частота виникнення тяжкої гіпоглікемії (представлена у вигляді кількості учасників дослідження, у яких спостерігалися такі епізоди, на 100 пацієнто-років лікування) становила 1,05 в групі застосування інсуліну гларгіну і 0,30 в групі застосування стандартної терапії, а частота підтверджених епізодів нетяжкої гіпоглікемії становила 7,71 в групі застосування інсуліну гларгіну і 2,44 в групі застосування стандартної терапії. Протягом цього 6-річного дослідження у 42 % пацієнтів в групі застосування інсуліну гларгіну взагалі не спостерігалося епізодів гіпоглікемії.
Під час останнього візиту на фоні досліджуваного лікування спостерігалося підвищення маси тіла від вихідного рівня в групі застосування інсуліну гларгіну в середньому на 1,4 кг і її зниження в середньому на 0,8 кг в групі застосування стандартної терапії.
Діти та підлітки
Під час рандомізованого контрольованого клінічного дослідження діти (віком від 6 до 15 років), хворі на цукровий діабет І типу (n = 349) упродовж 28 тижнів отримували інсулінотерапію у базально-болюсному режимі, при якому перед кожним прийомом їжі вводився звичайний людський інсулін. Інсулін гларгін вводили 1 раз на ніч, а НПХ-інсулін вводився один або два рази на день. У обох групах вплив на рівень глікозильованого гемоглобіну та на частоту виникнення гіпоглікемії, що супроводжувалася клінічними проявами, був аналогічним, проте зниження рівня глюкози у плазмі крові натще порівняно з початковим показником було більшим у групі, яка отримувала інсулін гларгін, порівняно із групою, що отримувала НПХ. Також у групі, що отримувала інсулін гларгін, тяжкість гіпоглікемії була меншою. 143 пацієнти із тих, які отримували інсулін гларгін під час цього дослідження, продовжили лікування інсуліном гларгіном у межах неконтрольованого продовження цього дослідження, середня тривалість подальшого спостереження у якому становила 2 роки. При продовженні лікування інсуліном гларгіном жодних нових сигналів, які б свідчили про небезпеку, не було отримано.
Також було проведено перехресне порівняльне дослідження комбінацій інсуліну гларгіну з інсуліном ліспро і НПХ-інсуліну зі звичайним людським інсуліном (кожен вид лікування застосовувався впродовж 16 тижнів випадковим чином) за участю 26 підлітків, хворих на діабет ІІ типу, віком від 12 до 18 років. Як і в описаному вище дослідженні серед дітей, зниження рівня глюкози у крові натще порівняно з початковим рівнем було вищим у групі, що отримувала інсулін гларгін, порівняно із групою, у якій вводився НПХ-інсулін / звичайний людський інсулін. Зміни рівня гемоглобіну HbA1c порівняно з початковим рівнем були аналогічними в обох групах, проте нічні глікемічні показники були достовірно вищими у групі, що отримувала інсулін гларгін / інсулін ліспро, ніж у групі НПХ-інсулін / звичайний інсулін, при цьому середні найнижчі показники становили 5,4 мМ та 4,1 мМ. Відповідно і частота виникнення нічної гіпоглікемії становила 32 % у групі, що отримувала інсулін гларгін / інсулін ліспро, та 52 % у групі, що отримувала НПХ-інсулін / звичайний інсулін.
Було проведено 24-тижневе дослідження у паралельних групах, в якому взяли участь 125 дітей з цукровим діабетом І типу віком від 2 до 6 років, де інсулін гларгін, що призначався один раз на добу вранці, порівнювався із НПХ-інсуліном, що призначався один або два рази на добу як базальний інсулін. Учасники обох груп дослідження отримували болюсні ін’єкції інсуліну перед прийомом їжі.
Головна мета дослідження – продемонструвати, що НПХ-інсулін принаймні не має переваг перед інсуліном гларгіном стосовно сукупного ризику гіпоглікемій, – досягнута не була, і на фоні застосування інсуліну гларгіну спостерігалася тенденція до збільшення частоти гіпоглікемічних явищ [співвідношення частоти в групах застосування інсуліну гларгіну: НПХ [95 % довірчий інтервал (ДІ)] = 1,18 (0,97–1,44)].
Зміна показників рівнів глікозильованого гемоглобіну та глюкози в крові в обох досліджуваних групах була подібною. Жодних нових даних щодо безпеки досліджуваних препаратів у цьому дослідженні не спостерігалося.
Фармакокінетика.
Порівняння концентрації інсуліну в плазмі крові у здорових добровольців і у хворих на цукровий діабет вказувало на більш повільну та тривалішу абсорбцію, а також продемонструвало відсутність піка концентрації після підшкірної ін’єкції інсуліну гларгіну, порівняно з НПХ-інсуліном людини. Таким чином, отримані концентрації інсуліну гларгіну повністю відповідали профілю фармакодинамічної активності препарату у часі. На графіку, наведеному вище, продемонстрований профіль активності інсуліну гларгіну та НПХ-інсуліну у часі.
При введенні інсуліну гларгіну 1 раз на добу рівноважна концентрація досягається через 2–4 дні після першої ін’єкції.
При внутрішньовенному введенні періоди напіввиведення інсуліну гларгіну та інсуліну людини були порівнянними.
Після підшкірної ін’єкції у пацієнтів з цукровим діабетом інсулін гларгін швидко метаболізується на карбоксильному кінці бета-ланцюга з утворенням двох активних метаболітів – M1 (21A-гліцин-інсулін) і M2 (21A-гліцин-дес-30B-треонін-інсулін). У плазмі крові головною циркулюючою сполукою є метаболіт М1. Експозиція М1 зростає пропорційно введеній дозі інсуліну гларгіну. Фармакокінетичні та фармакодинамічні дані свідчать про те, що ефект підшкірної ін’єкції інсуліну гларгіну пов’язаний переважно із експозицією М1. Інсулін гларгін та метаболіт М2 у більшості учасників досліджень не виявлялися, а коли їхній вміст можна було визначити, їхні концентрації не залежали від введеної дози інсуліну гларгіну.
У клінічних дослідженнях при аналізі підгруп, сформованих за віком і статтю, не було виявлено різниці у показниках безпечності та ефективності між пацієнтами, які отримували інсулін гларгін, та досліджуваною популяцією у цілому.
Діти та підлітки
Фармакокінетика препарату у дітей віком від 2 до 6 років з цукровим діабетом І типу оцінювалася у одному клінічному дослідженні (див. розділ «Фармакодинаміка»).
У дітей, які отримували інсулін гларгін, проводилося визначення мінімальних рівнів інсуліну гларгіну та його головних метаболітів (М1 і М2) в плазмі крові, за результатами якого було встановлено, що закономірності змін концентрацій в плазмі крові подібні до таких у дорослих, і не було виявлено жодних доказів на користь кумуляції інсуліну гларгіну або його метаболітів при тривалому застосуванні препарату.
Доклінічні дані з безпеки
У рамках стандартних досліджень з вивчення фармакологічної безпеки, токсичності при багатократному застосуванні препарату, генотоксичності, канцерогенного потенціалу і токсичності для репродуктивної функції не виявлено особливої небезпеки для людини.
Клінічні характеристики.
Лікування цукрового діабету у дорослих, підлітків та дітей віком від 2 років.
Підвищена чутливість до діючої речовини або до будь-якої допоміжної речовини, що входить до складу лікарського засобу.
Існує ряд речовин, які впливають на метаболізм глюкози, а отже, їх застосування може вимагати корекції дози інсуліну гларгіну.
До речовин, які можуть посилювати гіпоглікемічний ефект інсуліну та збільшувати схильність до виникнення гіпоглікемії, належать пероральні протидіабетичні лікарські засоби, інгібітори ангіотензинперетворювального ферменту (АПФ), дизопірамід, фібрати, флуоксетин, інгібітори моноаміноксидази (МАО), пентоксифілін, пропоксифен, саліцилати та сульфаніламідні протимікробні засоби.
До речовин, які можуть послаблювати гіпоглікемічний ефект інсуліну, належать кортикостероїди, даназол, діазоксид, сечогінні засоби, глюкагон, ізоніазид, естрогени та прогестини, похідні фенотіазину, соматропін, препарати-симпатоміметики (епінефрин (адреналін), сальбутамол, тербуталін), гормони щитовидної залози, атипові антипсихотичні лікарські засоби (наприклад, клозапін, оланзапін) та інгібітори протеаз.
Бета-блокатори, клонідин, солі літію або алкоголь можуть як посилювати, так і послаблювати гіпоглікемічний ефект інсуліну. Пентамідин може викликати гіпоглікемію, після якої іноді настає гіперглікемія.
Крім того, під дією симпатолітичних засобів, таких як бета-блокатори, клонідин, гуанетидин та резерпін, ознаки адренергічної контррегуляції можуть слабшати або зовсім зникати.
Айлар® не є препаратом вибору для лікування діабетичного кетоацидозу. Замість нього у таких випадках рекомендується внутрішньовенне введення звичайного (регуляр) інсуліну.
Якщо у результаті лікування не вдається досягти достатнього контролю рівня глюкози або спостерігається тенденція до збільшення епізодів гіпо- чи гіперглікемії, перед тим як змінювати дозування препарату, слід перевірити, чи дотримується хворий рекомендацій щодо режиму лікування, місця введення препарату, належної техніки ін’єкційного введення, а також оцінити інші важливі фактори, які впливають на ефективність лікування.
Переведення пацієнта на інший тип або марку інсуліну має відбуватися під ретельним медичним наглядом. У разі зміни сили дії, марки (виробника), типу (регуляр, НПХ, ленте, тривалої дії і т. ін.), походження (тваринний, людський, аналог людського інсуліну) та/або методу виробництва може виникнути необхідність змінити дозу інсуліну.
Введення препаратів інсуліну може викликати утворення антитіл до нього. У поодиноких випадках через наявність антитіл до інсуліну може виникати потреба у корекції дози для профілактики гіпо- або гіперглікемії (див. розділ «Побічні реакції»).
Гіпоглікемія
Час, через який розвивається гіпоглікемія, залежить від профілю дії інсулінів, що застосовуються, і тому може змінюватися при зміні режиму лікування. Через більш стабільне надходження в організм базального інсуліну при застосуванні лікарського засобу Айлар® імовірність виникнення гіпоглікемії у нічний час менша, тоді як у ранні ранкові години гіпоглікемія є більш імовірною.
Дотримуватися особливої обережності і посилено контролювати рівень глюкози у крові необхідно пацієнтам, у яких напади гіпоглікемії можуть бути особливо небезпечними з клінічної точки зору, зокрема пацієнтам з вираженим стенозом коронарних артерій або кровоносних судин, що постачають кров’ю головний мозок (ризик серцевих чи мозкових ускладнень гіпоглікемії), а також пацієнтам з проліферативною ретинопатією, яким не проводилася фотокоагуляція (ризик виникнення транзиторної постгіпоглікемічної сліпоти).
Пацієнти повинні знати про те, що за певних обставин перші симптоми розвитку гіпоглікемії можуть бути менш помітними. Симптоми, що вказують на розвиток гіпоглікемії, можуть змінюватися, ставати менш вираженими або бути взагалі відсутніми у пацієнтів, що належать до певних груп ризику. Серед них хворі:
У таких ситуаціях може виникати тяжка гіпоглікемія (можливо, із втратою свідомості) ще до того, як пацієнт зрозуміє, що у нього знизився рівень глюкози у крові.
Оскільки інсулін гларгін при підшкірному введенні діє впродовж тривалого періоду часу, це може призвести до того, що для нормалізації глікемічного стану вимагатиметься більше часу.
Якщо у хворого спостерігається нормальний чи знижений рівень глікозильованого гемоглобіну, це може вказувати на виникнення у нього періодичних недіагностованих (особливо нічних) епізодів гіпоглікемії.
Для зменшення ризику виникнення гіпоглікемії дуже важливими є дотримання пацієнтом дози препарату, режиму харчування, правильне введення інсуліну, а також проінформованість хворого стосовно симптомів гіпоглікемії. Існує ряд факторів, які підвищують схильність до виникнення гіпоглікемії та вимагають ретельного спостереження за станом хворого, а іноді і корекції дози лікарського засобу. До них належать:
Пацієнтів потрібно попередити про необхідність постійно змінювати місце ін’єкції, щоб зменшити ризик розвитку ліподистрофії та амілоїдозу шкіри. Існує потенційний ризик затримки абсорбції інсуліну та погіршення глікемічного контролю після ін’єкцій інсуліну в місцях цих реакцій. Повідомляється, що зміна місця ін’єкції на неуражену ділянку шкіри призводить до гіпоглікемії. Рекомендується проводити моніторинг рівня глюкози в крові після зміни місця введення, і можна врахувати коригування дози антидіабетичних препаратів.
Супутні захворювання
Наявність супутнього захворювання вимагає посилення контролю за метаболічними показниками. У багатьох випадках показане проведення аналізу сечі на присутність кетонових тіл, і часто виникає необхідність у корекції дози інсуліну. Потреба в інсуліні нерідко може зростати. Пацієнтам, хворим на цукровий діабет І типу, необхідно продовжувати регулярно споживати хоча б невелику кількість вуглеводів, навіть якщо вони здатні приймати лише незначну кількість їжі чи зовсім не можуть приймати їжу або у них виникає блювання. Вони ніколи не повинні припиняти застосування інсуліну повністю.
Антитіла до інсуліну
Введення препаратів інсуліну може зумовити утворення антитіл до нього. У рідкісних випадках через наявність антитіл до інсуліну може виникати потреба у корекції дози, щоб попередити виникнення гіпо- або гіперглікемії (див. розділ «Фармакологічні властивості»).
Користування шприц-ручкою
Перед використанням шприц-ручки слід уважно прочитати інструкцію з її застосування. Айлар® потрібно використовувати відповідно до інструкції.
Помилкове введення іншого препарату
Надходили повідомлення про помилкове введення препаратів, коли замість інсуліну гларгіну випадково вводили інші інсуліни, зокрема інсуліни короткої дії. Перед кожною ін’єкцією слід перевіряти етикетку на інсуліні, щоб уникнути помилкового введення замість інсуліну гларгіну інших інсулінів.
Комбінація лікарського засобу Айлар® з піоглітазоном
Про випадки серцевої недостатності повідомлялося при застосуванні піоглітазону в поєднанні з інсуліном, особливо у пацієнтів з ризиком розвитку серцевої недостатності. Це слід враховувати, розглядаючи можливість лікування комбінацією піоглітазону та препарату Айлар®. При застосуванні цієї комбінації пацієнти мають бути під наглядом через можливість виникнення симптомів серцевої недостатності, збільшення маси тіла і набряку. У разі будь-якого погіршення кардіологічних симптомів застосування піоглітазону необхідно припинити.
Цей лікарський засіб містить менше 1 ммоль/дозу натрію (23 мг), тобто практично вільний від натрію.
Застосування у період вагітності або годування груддю.
Вагітність. Не існує даних контрольованих клінічних досліджень стосовно застосування інсуліну гларгіну у період вагітності. Дані, отримані під час постмаркетингового спостереження, щодо застосування цього препарату вагітним жінкам (дані про більш ніж 1000 випадків вагітності) вказують на те, що інсулін гларгін не має шкідливого впливу на перебіг вагітності, а також не спричиняє ані вад розвитку у плода/новонародженого, ані токсичного впливу на нього. Не виявлено ознак репродуктивної токсичності у тварин. Препарат Айлар® можна призначати під час вагітності, якщо у цьому є потреба.
Пацієнткам, хворим на цукровий діабет, що виник до вагітності, та пацієнткам з гестаційним діабетом упродовж усього періоду вагітності дуже важливо підтримувати належний метаболічний контроль, щоб запобігти розвитку небажаних клінічних наслідків, асоційованих з гіперглікемією. Потреба в інсуліні може зменшуватися протягом І триместру вагітності та, як правило, зростати протягом ІІ та ІІІ триместрів. Одразу після пологів потреба в інсуліні стрімко знижується (збільшується ризик виникнення гіпоглікемії). Тому дуже велике значення має ретельний контроль рівня глюкози у крові.
Годування груддю. Поки що невідомо, чи виділяється інсулін гларгін у грудне молоко. Жодних метаболічних ефектів, спричинених проникненням інсуліну гларгіну в організм новонародженого/немовляти із грудним молоком, не очікується, оскільки інсулін гларгін є пептидом, який у шлунково-кишковому тракті людини розщеплюється на амінокислоти. Однак жінки під час грудного годування можуть потребувати корекції дози препарату та дієти.
Репродуктивна функція.
Не виявлено безпосереднього шкідливого впливу на репродуктивну функцію у тварин.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Здатність пацієнта до концентрації уваги та швидкість його реакції можуть порушуватися внаслідок виникнення гіпоглікемії чи гіперглікемії або, наприклад, унаслідок зорових розладів. Це може бути небезпечним у тих ситуаціях, коли ці якості є особливо важливими (під час керування транспортними засобами або роботи з механізмами).
Пацієнтам необхідно порадити вживати необхідних запобіжних заходів з метою уникнення гіпоглікемії під час керування транспортним засобом. Це є особливо важливим для тих пацієнтів, у яких перші ознаки розвитку гіпоглікемії є слабко вираженими або взагалі відсутні, а також для тих хворих, у яких гіпоглікемія виникає досить часто. Слід ретельно зважити, чи варто сідати за кермо або працювати з механізмами у такому стані.
Дозування
Айлар® містить інсулін гларгін – аналог інсуліну тривалої дії. Препарат вводять один раз на день у будь-який час доби, але щоразу в один і той самий час. Шприц-ручка дозволяє вводити дози інсуліну з кроком у 1 одиницю.
Режим дозування лікарського засобу Айлар® (доза та час введення) слід підбирати індивідуально. Пацієнтам, хворим на цукровий діабет ІІ типу, Айлар® також можна застосовувати одночасно з пероральними протидіабетичними лікарськими засобами. Сила дії цього лікарського засобу виражається в одиницях. Ці одиниці застосовуються винятково для препарату Айлар® і відрізняються від МО чи одиниць, у яких виражається сила дії інших аналогів інсуліну.
Діти і підлітки
Застосовується дітям віком від 2 років.
Безпечність і ефективність інсуліну гларгіну були доведені при його застосуванні підліткам та дітям віком від 2 років (див. розділ «Фармакологічні властивості»).
Застосування інсуліну гларгіну дітям віком до 2 років не вивчалося.
Пацієнти літнього віку (від 65 років)
У людей літнього віку вікове прогресуюче погіршення функції нирок може стати причиною постійного зменшення потреби в інсуліні.
Ниркова недостатність
У пацієнтів з нирковою недостатністю потреба в інсуліні може бути зменшена через послаблення метаболізму інсуліну.
Печінкова недостатність
У пацієнтів з печінковою недостатністю потреба в інсуліні може зменшуватися через зниження здатності до глюконеогенезу та уповільнення метаболізму інсуліну.
Перехід від інших інсулінів на препарат Айлар®
При переході від схем лікування інсулінами середньої тривалості дії або тривалої дії на схему лікування препаратом Айлар® може виникнути потреба у зміні дози базального інсуліну, а також у корекції супутньої протидіабетичної терапії (доз і часу введення додатково застосовуваних звичайних (регуляр) інсулінів або аналогів інсуліну швидкої дії чи доз пероральних протидіабетичних лікарських засобів).
Переведення з дворазового введення НПХ-інсуліну на препарат Айлар®
Щоб зменшити ризик розвитку гіпоглікемії у нічні або у ранні ранкові години, пацієнтам, які змінюють режим застосування базального інсуліну з дворазового введення НПХ-інсуліну на одноразове введення Айлару®, потрібно зменшити дозу базального інсуліну на 20–30 % протягом перших тижнів лікування.
Переведення з інсуліну гларгіну 300 одиниць/мл на лікарський засіб Айлар®
Щоб знизити ризик розвитку гіпоглікемії, пацієнтам, які змінюють режим застосування базального інсуліну з одноразового введення (інсуліну гларгіну 300 одиниць/мл) на одноразове введення лікарського засобу Айлар®, потрібно зменшити дозу базального інсуліну приблизно на 20 %.
Упродовж цього періоду зниження дози має бути, принаймні частково, компенсовано збільшенням дози інсуліну, введення якого пов’язане із прийманням їжі. Після завершення цього періоду режим дозування слід коригувати індивідуально.
Як і при застосуванні інших аналогів інсуліну, у пацієнтів, які отримують великі дози інсуліну через наявність антитіл до людського інсуліну, при переході на Айлар® може спостерігатися покращення відповіді організму на введення інсуліну.
Під час переходу на інший препарат та впродовж перших тижнів після цього рекомендується ретельно контролювати метаболічні показники.
Покращання метаболічного контролю і пов’язане з цим збільшення чутливості до інсуліну можуть потребувати додаткової корекції режиму дозування. Корекція дози також може потребуватися, наприклад, при зміні маси тіла хворого чи зміні його способу життя, зміні часу доби, коли здійснюється введення інсуліну, або при виникненні інших факторів, які сприяють підвищенню схильності до розвитку гіпо- або гіперглікемії (див. розділ «Особливості застосування»).
Спосіб введення
Айлар® слід вводити підшкірно.
Айлар® не можна вводити внутрішньовенно. Тривала дія препарату Айлар® зумовлена його введенням у підшкірно-жирову тканину. Внутрішньовенне введення звичайної підшкірної дози може призвести до виникнення тяжкої гіпоглікемії.
Немає клінічно значущої різниці у рівнях інсуліну або глюкози у плазмі крові після введення інсуліну гларгіну в абдомінальну ділянку, ділянку дельтоподібного м’яза або стегна. При кожній наступній ін’єкції місце уколу слід щоразу змінювати в межах ділянки тіла, рекомендованої для введення інсуліну, щоб зменшити ризик розвитку ліподистрофії та амілоїдозу шкіри (див. розділи інструкції «Особливості застосування» і «Побічні реакції»).
Айлар® не можна змішувати з будь-яким іншим інсуліном або розводити. При змішуванні або розведенні може змінитися профіль дії препарату у часі. Крім цього, змішування з іншими інсулінами може призвести до утворення осаду.
Шприц-ручка для інсуліну
Введення лікарського засобу Айлар® у картриджах передбачає необхідність використання відповідного дозуючого пристрою – шприц-ручки. Рекомендується використовувати пристрої: VitalPen (Copernicus Sp. z o. o., Польща), i-PEN (INSUPen) («Biocon Limited», Індія) або аналогічні.
Шприц-ручки слід використовувати згідно з рекомендаціями, наданими виробником ін’єкційного пристрою.
Слід чітко дотримуватися інструкцій виробника щодо використання шприц-ручки під час заправки картриджа, приєднання голки та введення інсуліну.
Якщо шприц-ручка для введення інсуліну пошкоджена або не працює належним чином (через механічні дефекти), її слід знищити, а замість неї використовувати нову шприц-ручку.
У разі несправності шприц-ручки (див. інструкцію з використання шприц-ручки) розчин з картриджа можна набрати у шприц (що підходить для введення інсуліну та розрахований на 100 одиниць/мл) і зробити ін’єкцію.
Картридж
Перед тим як вставити картридж у шприц-ручку, його необхідно витримати впродовж 1–2 годин при кімнатній температурі. Потрібно перевірити картридж перед його використанням. Його можна застосовувати лише тоді, коли розчин у ньому є прозорим, безбарвним, без видимих твердих часточок та має таку ж консистенцію, як вода. Оскільки Айлар® є розчином, він не вимагає ресуспендування перед застосуванням.
Перед ін’єкцією слід видалити з картриджа всі бульбашки повітря (див. інструкцію з використання шприц-ручки). Не дозволяється наповнювати знову порожні картриджі.
Перед кожною ін’єкцією слід перевіряти етикетку на інсуліні, щоб уникнути помилкового введення замість інсуліну гларгіну інших інсулінів (див. розділ «Особливості застосування»).
Флакон
Перевірити флакон перед його використанням. Його можна застосовувати лише тоді, коли розчин у ньому є прозорим, безбарвним, без видимих твердих часточок та має таку ж консистенцію, як вода.
Оскільки Айлар® є розчином, він не вимагає ресуспендування перед застосуванням.
Діти.
Препарат застосовувати дітям віком від 2 років тільки під ретельним медичним наглядом.
Симптоми
Передозування інсуліну може призвести до тяжкої, а іноді тривалої гіпоглікемії, яка може бути небезпечною для життя хворого.
Лікування
Нетяжку гіпоглікемію зазвичай можна скоригувати пероральним застосуванням вуглеводів. Може потребуватися також корекція дози лікарського препарату і внесення змін у режим харчування чи фізичної активності.
Більш тяжка гіпоглікемія, яка супроводжується комою, судомами або неврологічними порушеннями, вимагає внутрішньом’язового/підшкірного введення глюкагону або внутрішньовенного введення концентрованого розчину глюкози. Оскільки гіпоглікемія може повторитися навіть після явного покращання клінічного стану хворого, необхідними заходами є тривале приймання вуглеводів і спостереження за пацієнтом.
Гіпоглікемія, як правило, є найчастішою побічною реакцією, що спостерігається під час інсулінотерапії. Вона виникає тоді, коли доза введеного інсуліну набагато перевищує потребу у ньому.
Небажані реакції, пов’язані із застосуванням препарату, що спостерігалися під час клінічних досліджень, наводяться нижче за системами органів згідно з MedDRA та за частотою виникнення: дуже часто (≥ 1/10); часто (≥ 1/100 – < 1/10); нечасто (≥ 1/1 000 – < 1/100); рідко (≥ 1/10 000 – < 1/1 000); дуже рідко (< 1/10 000); невідомо (неможливо визначити за наявною інформацією).
З боку імунної системи: рідко – алергічні реакції.
Метаболічні та аліментарні розлади: дуже часто – гіпоглікемія.
З боку нервової системи: дуже рідко – дисгевзія.
З боку органів зору: рідко – порушення зору, ретинопатія.
З боку шкіри та підшкірних тканин: часто – ліпогіпертрофія; нечасто – ліпоатрофія; невідомо –
амілоїдоз шкіри.
З боку опорно-рухової системи та сполучної тканини: дуже рідко – міалгія.
Порушення загального стану та реакції у місці введення: часто – реакції у місці ін’єкційного введення препарату; рідко – набряк.
Метаболічні та аліментарні розлади
Тяжкі епізоди гіпоглікемії, особливо якщо вони виникають неодноразово, можуть стати причиною ураження нервової системи. Тривала або тяжка гіпоглікемія може становити загрозу для життя хворого.
У багатьох пацієнтів появі симптомів, що свідчать про недостатнє надходження глюкози до тканин головного мозку (нейроглікопенія), передують ознаки адренергічної контррегуляції. Як правило, чим більше та швидше знижується рівень цукру в крові, тим більш вираженою є адренергічна контррегуляція та інтенсивніше проявляються характерні симптоми.
Розлади з боку імунної системи
Реакції гіперчутливості негайного типу на інсулін виникають рідко. Проявами таких реакцій на інсулін (у тому числі на інсулін гларгін) або допоміжні речовини можуть бути генералізовані реакції з боку шкіри, ангіоневротичний набряк, бронхоспазм, гіпотензія і шок, які можуть становити загрозу для життя хворого.
Введення препаратів інсуліну може зумовити утворення антитіл до нього. Під час клінічних випробувань у групах пацієнтів, які отримували лікування НПХ-інсуліном та інсуліном гларгіном, утворення антитіл, що перехресно реагували з людським інсуліном, спостерігалося з однаковою частотою. У поодиноких випадках через наявність антитіл до інсуліну може виникати потреба у корекції дози, щоб попередити виникнення гіпо- або гіперглікемії.
Розлади з боку органів зору
Значна зміна рівня глюкози у крові може спричинити тимчасове порушення зору внаслідок тимчасової зміни тургору та порушення рефракції кришталика.
Ризик прогресування діабетичної ретинопатії зменшується при досягненні тривалої нормалізації рівня глюкози у крові. Однак інтенсифікація інсулінотерапії із раптовим покращенням глікемічного контролю може супроводжуватися тимчасовим погіршенням перебігу діабетичної ретинопатії. У хворих на проліферативну ретинопатію, особливо у тих, яким не проводилася фотокоагуляція, епізоди тяжкої гіпоглікемії можуть призвести до виникнення тимчасової втрати зору.
Розлади з боку шкіри та підшкірних тканин
Як і при застосуванні будь-яких інших препаратів інсуліну, у місці ін’єкційного введення можуть виникати розлади шкіри та підшкірної клітковини – ліподистрофія та амілоїдоз шкіри, внаслідок чого швидкість всмоктування інсуліну у місці ін’єкції зменшується. Постійна зміна місця ін’єкції в межах ділянки ін’єкції може допомогти зменшити або запобігти цим реакціям (див. розділ «Особливості застосування»).
Порушення загального стану та реакції у місці введення
До реакцій, що виникають у місці введення, належать почервоніння шкіри, біль, свербіж, кропив’янка, припухлість або запалення. Більшість нетяжких реакцій на інсулін, які виникають в місці введення препарату, зазвичай минають упродовж періоду від кількох днів до кількох тижнів.
Зрідка інсулін може призводити до затримки в організмі натрію та появи набряків, особливо у випадках, коли завдяки посиленню інтенсивності інсулінотерапії вдається покращити глікемічний контроль, який до цього не був адекватним.
Діти та підлітки
Загалом профіль безпеки препарату у дітей (до 18 років) не відрізняється від його профілю безпеки у дорослих пацієнтів.
У звітах про побічні реакції, отриманих під час постмаркетингового спостереження, повідомлялося про частіше виникнення реакцій у місці введення препарату (біль у місці введення препарату, реакція у місці введення препарату), а також реакцій з боку шкіри (висип, кропив’янка) у дітей та підлітків (≤ 18 років) порівняно із дорослими.
Дані досліджень з безпеки застосування лікарського засобу дітям віком до 2 років наразі відсутні.
Повідомлення про підозрювані побічні реакції
Повідомлення про підозрювані побічні реакції після схвалення лікарського засобу дозвільними органами є важливою процедурою. Це дає змогу здійснювати постійний моніторинг співвідношення користі/ризику застосування цього лікарського засобу. Медичні працівники повинні повідомляти про усі підозрювані побічні реакції через систему фармаконагляду.
Картриджі – 2 роки.
Флакони – 2 роки.
Термін придатності після першого використання картриджа
Термін придатності препарату у картриджі після відкриття – 28 діб за умови зберігання при температурі не вище 25 °C. Захищати від перегрівання та прямих сонячних променів.
Картриджі, які використовуються, не слід тримати у холодильнику.
Термін придатності після першого відкриття флакона
Термін придатності препарату у флаконі після відкриття – 28 діб за умови зберігання при температурі не вище 25 °C. Захищати від перегрівання та прямих сонячних променів. Зберігати флакон у зовнішній картонній упаковці з метою захисту від дії світла.
Рекомендується зазначати на етикетці дату першого відкриття флакона.
Зберігати у недоступному для дітей місці!
Невідкриті картриджі
Зберігати при температурі від +2 °C до +8 °C (у холодильнику). Не заморожувати!
Не допускати контакту з морозильним відділенням або накопичувачами холоду.
Зберігати картридж у зовнішній картонній упаковці з метою захисту від дії світла.
Картриджі після першого використання
Умови зберігання див. у розділі «Термін придатності».
Невідкриті флакони
Зберігати при температурі від +2 °C до +8 °C (у холодильнику). Не заморожувати!
Не допускати контакту з морозильним відділенням або накопичувачами холоду.
Зберігати флакон у зовнішній картонній упаковці з метою захисту від дії світла.
Флакони після відкриття
Умови зберігання див. у розділі «Термін придатності».
Цей лікарський засіб не можна змішувати з іншими лікарськими засобами.
По 3 мл у картриджі. По 5 картриджів у блістері, по 1 блістеру в пачці.
По 10 мл у флаконі. По 1 флакону в пачці.
За рецептом.
АТ «Фармак».
Місцезнаходження виробника та адреса місця провадження його діяльності.
Україна, 04080, м. Київ, вул. Кирилівська, 74.
Дата оновлення інструкції. 29.10.2024.